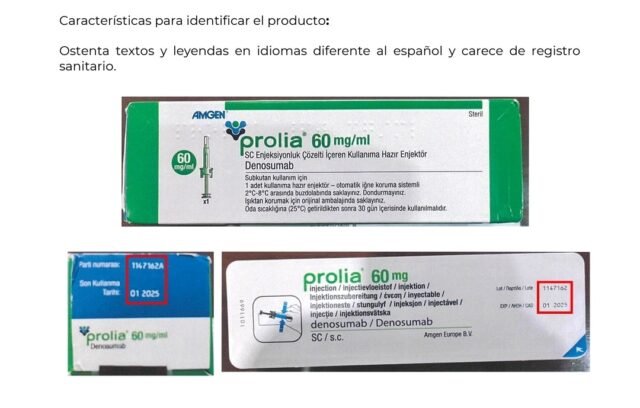
Redacción.- La Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) ha emitido una alerta sanitaria respecto a la comercialización irregular del producto Prolia 60mg/mL (Denosumab) en presentación de jeringa prellenada. Este medicamento está autorizado para el tratamiento de la osteoporosis en mujeres posmenopáusicas y en varones con riesgo elevado de fracturas.
La empresa titular del registro sanitario, Amgen México, S.A. de C.V., ha informado que se ha identificado la distribución de un lote específico (1147162A) destinado originalmente para Turquía, el cual ha llegado de manera irregular al mercado mexicano. Además de presentar textos y leyendas en idiomas distintos al español y carecer de registro sanitario en México, Prolia se utiliza para el tratamiento de la pérdida ósea asociada con la supresión hormonal en hombres con cáncer de próstata con riesgo elevado de fracturas, así como para la pérdida ósea asociada con el tratamiento sistémico a largo plazo con glucocorticoides en adultos con riesgo elevado de fracturas.
La COFEPRIS advierte que este medicamento no ha sido importado por la empresa titular y, por lo tanto, no cuenta con registro sanitario otorgado para México. Esto implica un riesgo para la salud, ya que se desconocen las condiciones de transporte, almacenamiento y distribución.
Ante esta situación, la COFEPRIS recomienda a la población, profesionales de la salud, distribuidores y farmacias no utilizar ni adquirir productos que presenten idioma diferente al español y carezcan de registro sanitario. En caso de dudas, se insta a contactar al titular del registro sanitario para confirmar la identidad del producto. Además, se hace un llamado a no adquirir el producto si se identifican los números de lote mencionados y, en caso de tener información sobre su comercialización, realizar denuncias sanitarias correspondientes. Cualquier reacción adversa o malestar después de usar el producto debe ser reportado en línea o al correo electrónico farmacovigilancia@cofepris.gob.mx.